选项 | 实验内容 | 实验目的 |
A | 向两支盛有5 mL不同浓度KMnO4溶液的试管中分别加入同浓度同体积的足量草酸溶液,观察实验现象 | 探究浓度对反应速率的影响 |
B | 向盛有1 mL 20%蔗糖溶液的试管中滴入3 ~ 5滴稀硫酸,将混合液煮沸几分钟、冷却,在冷却后的溶液中加入银氨溶液 | 检验蔗糖的水解产物中是否有葡萄糖 |
C | 向盛有2 g碳酸钠粉末的试管中加入少量水后,碳酸钠粉末结块变成晶体,用手触摸试管壁 | 验证碳酸钠粉末遇水生成碳酸钠晶体是放热反应 |
D | 向盛有5 mL 0.05 mol·L-1FeCl3溶液的试管中加入1 mL 0.15 mol·L-1 KSCN 溶液,溶液显红色,再加入1mol· L-1 KSCN溶液 | 验证 Fe3+和SCN-的反应为可逆反应 |
| A | B | C | D | |
| 操作 | | | | |
| 现象 | 溶液变浑浊 | 无气泡生成 | 固体结块,试管底部温度升高 | 溶液先变红,后褪色 |
| 解释或结论 | 稀盐酸将硫代硫酸钠还原为硫单质 | 硼酸的酸性弱于碳酸 | 生成纯碱晶体的反应是放热反应 | 亚硫酸既有酸性又有漂白性 |
| 选项 | 实验目的 | 操作 |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大的一块,小心放入装满水的烧杯中 |
| B | 除去 | 对固体混合物进行加热 |
| C | 证明 | |
| D | 制取氢氧化铁胶体 | 将0.01mol/L NaOH溶液滴入0.1mol/L |
 B . 证明过氧化钠与水反应放热
B . 证明过氧化钠与水反应放热  C . 制备并收集少量NO2气体
C . 制备并收集少量NO2气体  D . 实验室制备少量氨气
D . 实验室制备少量氨气 
| | | | |
| 反应开始后,针简活塞向右移动 | 反应物总能量大于生成物总能量 | 反应开始后,U形管的液面左低右高 | 温度计的水银柱不断上升 |
| A | B | C | D |
 B .
B .  C .
C .  D .
D . 
序号 | 液体 | 固体 | 混合前温度 | 混合后最高温度 |
① | 35mL水 | 2.5g NaHCO3 | 20℃ | 18.5℃ |
② | 35mL水 | 3.2g Na2CO3 | 20℃ | 24.3℃ |
③ | 35mL盐酸 | 2.5g NaHCO3 | 20℃ | 16.2℃ |
④ | 35mL盐酸 | 3.2g Na2CO3 | 20℃ | 25.1℃ |
下列反应中,属于放热反应且是氧化还原反应的是____(填字母).

①由和
变成
、
需要(“放出”或“吸收”)能量。
②和
反应生成
, 共放出
能量。
Ⅱ.燃料电池在工作时,从负极连续通入、
、
等燃料,从正极连续通入
, 以
或
溶液为电解质溶液,发生反应生成
、
或
等,同时产生电能,目前已研制成功
空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。

①电极M是(填“正极”或“负极”),电极N的电极反应式为。
②若该燃料电池消耗(标准状况下)
, 则理论上电路中转移
电子。
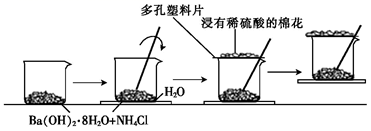
实验装置如图所示,调节U形管内两侧液面相平,向试管中加入 粉末,再滴加
蒸馏水及2~3滴酚酞试液,试管内产生大量气泡,溶液先变红后褪色。

①观察到U形管内液面(填标号),说明该反应为放热反应。
A.左侧较高B.右侧较高C.左、右两侧一样高
②写出该反应的离子方程式.
限选仪器及试剂:试管、胶头滴管、温度计、蒸馏水、酚酞试液、 粉末。
①提出合理猜想:
猜想一:反应放热,酚酞受热分解,使溶液红色褪去;
猜想二:。
②设计方案证明猜想:向 中加入
蒸馏水,所得溶液分别置于试管1和试管2中,请将实验操作、现象和结论补充完整:
| 实验操作 | 实验现象 | 实验结论 |
| 将试管1中溶液冷却至室温,滴加2~3滴酚酞 |
| 猜想一不成立 |
| 向试管2中加入少量 | 振荡时,产生大量气泡;滴加酚酞后, | 猜想二成立 |
③在试管2中,加入少量 粉末的作用是。


①下图能正确表示该反应中能量变化的是;
A、 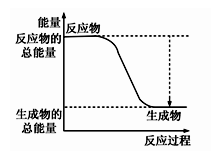
B、 
②根据下表数据,计算生成1molNH3时该反应放出的热量为kJ;
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=,反应开始与平衡时气体的物质的量之比为;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 , 请用p0、p来表示达到平衡时H2的转化率为。
④在③反应条件下,能够判断该反应已经达到化学平衡状态的是。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成nmolN2的同时生成2nmolNH3
D.v(N2)=2v(NH3)

①装置甲中SO42-向极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为mol。

①若如图1所示,发生的反应(假设没有气体生成)是(填“放热”或“吸热”)反应,X可以是(填化学式,只填一种即可)。
②若如图2所示,发生的反应(假设没有气体生成)是(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是(填字母)。
A.CO还原CuO的反应 B.CaCO3的分解反应 C.Al和Fe2O3的反应

图3
实验中观察到的现象是:大试管中铝片逐渐溶解、有大量气泡产生、烧杯中澄清的石灰水变浑浊,其中“石灰水变浑浊”的主要原因是。
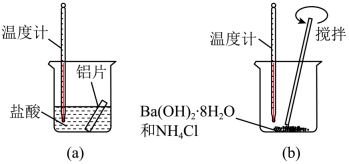
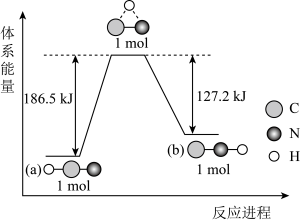
①在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是热反应,(b)中温度降低,由此可以判断(b)中反应是热反应。
②写出铝与盐酸反应的离子方程式:。
③根据能量守恒定律,(b)中反应物的总能量应该(填“高于”或“低于”)其生成物的总能量。

①化学键断裂需要(填“释放”或“吸收”)能量。
②图中共释放的能量为kJ。
③该反应的反应物的总能量(填“大于”、“等于”或“小于”)生成物的总能量,所以该反应是反应。
①若M为钠,则实验过程中烧杯中可观察到的现象是。
②若观察到烧杯中产生气泡,则说明M溶于水(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是。
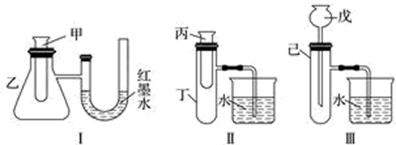
方法①:选择装置(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到脱脂棉燃烧,则说明该反应是(填“吸热”或“放热”)反应。
①液态水汽化 ②稀释浓硫酸
③高温下碳酸钙分解 ④镁条与盐酸反应
⑤硝酸铵固体溶于水 ⑥铁丝在纯氧中燃烧
⑦氢氧化钾溶液与硝酸反应 ⑧八水合氢氧化钡固体与氯化铵固体混合搅拌
未发生化学键破坏的是;仅发生离子键破坏的是。上述涉及的主要物质为纯净物时,属于共价化合物的是;属于离子化合物的是。

则正极反应式为,溶液中的阴离子移向(填“正”或“负”)极,电极材料X不能是(填序号)。
A. B.
C.
D.石墨
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤碳与二氧化碳高温反应 ⑥食物因氧化而腐败


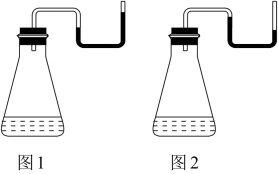
某同学选用装置I进行实验(实验前 U 形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U 形管中可观察到的现象是。
①观察到烧杯里产生气泡,则可推出 M 溶于水是放热反应(填“一定”或“可能” ),理由是;
②若观察到烧杯里的玻璃管内形成一段水柱,则M可能是。
方法①:选择上述装置(填 “I”或“III”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是反应。

请回答下列问题:
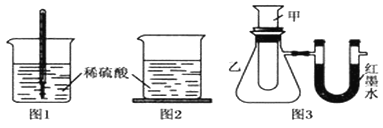
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L﹣1稀硫酸,再插入一支温度计,温度计的温度由20℃逐渐升至35℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L﹣1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
① | 氧化钙与水 | 左低右高 |
② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
③ | 铝片与烧碱溶液 | 左低右高 |
④ | 铜与浓硝酸 | 左低右高 |
根据上述实验回答相关问题:
