 B .
B . 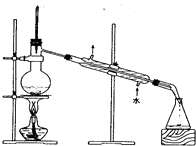 C .
C .  D .
D . 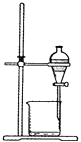
①下列做法不利于改善空气质量的是。
a.工厂通过静电除尘减少悬浮颗粒物排放
b.以新能源公交车代替燃油公交车
c.夜间排放工业废气
② 公共场所安装直饮水设备,方便市民饮用。直饮水需要经过活性炭处理、超滤膜过滤、紫外灯照射等处理过程。其中活性炭作为。
a. 混凝剂 b. 吸附剂 c.杀菌、消毒剂
③ 宿迁40余处“落叶景观带”成为扮靓城市的秋冬美景,为保护落叶景观带设置的“严禁烟火”标志是。

a b c
① 红薯中含有的可有效改善牙龈出血。
a.维生素A b.维生素B c.维生素C
② 以上成分中,(填元素符号)为人体必需的微量元素。
③ 红薯中含有丰富的淀粉,其在人体内完全水解的最终产物是(填化学式)。实验室检验该水解产物所用的试剂是。
④ 红薯不宜过多食用,否则会产生较多胃酸。双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它和胃酸反应的化学方程式为:。

① 工业上生产水泥、玻璃都用到的原料是。
② 深埋在海水中的钢管桩易发生腐蚀,下列保护钢管桩的措施不合理的是。
a.使用抗腐蚀性强的合金钢
b.在钢材表面喷涂防腐涂料
c.钢管桩附着铜以增强抗腐蚀性
③ 港珠澳大桥工程使用了大量密封橡胶衬垫。为使橡胶性能更好,天然橡胶需经过处理以增强其机械性能。
④ 光导纤维是由高纯度SiO2于2000℃下拉制而成,工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2 , 该反应的化学方程式为:。
① 下列化合物中能发生消去反应的是(填字母)。
a.CH3OH b.CH3CH2Cl c.HC≡CH
② 下列化合物中,常温下能被空气氧化的是(填字母)。

③ 下列化合物中,能发生水解反应的是(填字母)。
a.H2C=CH2 b.CH3COOCH2CH3 c.CH3CH2OH
① 甲苯分子中一定共平面的碳原子有个。
② 甲苯苯环上的一溴代物有种,请写出其中一种的名称:。
③ 除去甲苯中混有的少量苯酚,可选用的试剂是,写出该反应的化学方程式:。

① A中含氧官能团的名称为和。
② B的结构简式为。
③ B→C的反应类型为。
④ C的同分异构体D能发生银镜反应,能与FeCl3溶液发生显色反应。且1 mol D最多能与2 mol NaOH反应。D分子中有4种不同化学环境的氢,请写出D的一种结构简式。

已知:“沉锰”反应为:Mn2+ + 2HCO = MnCO3↓+ H2O + CO2↑
